|
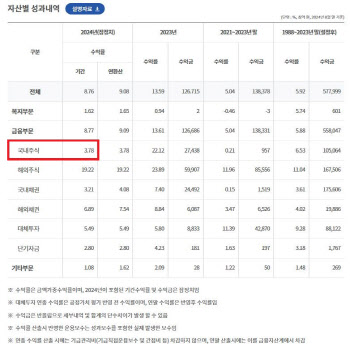
난소암 치료제 ‘셀그램-DC’와 전립선암 치료제 ‘셀그램-DC-PC’ 임상은 조기 종료할 예정이다. 셀그램-DC는 지난 2월, 셀그램-DC-PC는 지난해 7월 임상 1상 환자를 첫 등록했지만 이후 환자 등록이 저조해 조기 종료를 고려하고 있다. 신규 DC치료제로 파이프라인을 교체할 가능성이 높다.
해당 신약들은 비교적 초기 임상 단계인데다 핵심 파이프라인에 속하지 않기 때문에 정리 대상에 오른 것으로 추정된다. 파미셀 관계자는 “아직 조기 종료가 확실히 결정된 것은 아니다”라면서도 “신규 DC치료제에 대해 추가적으로 연구하고 있는 게 있다”고 언급했다.
핵심 파이프라인인 알코올성 간견병 줄기세포치료제 ‘셀그램-LC’의 경우 미국 임상 1상의 방향성에 대해 검토하고 있다.
그럼에도 파미셀은 줄기세포치료제 연구개발이 순항하고 있다는 입장이다. 파미셀은 핵심 파이프라인인 셀그램-LC와 발기부전 치료제 ‘셀그램-ED’, 만성신장질환 치료제 ‘셀그램-CKD’ 등이 환자 모집이 빠르게 진행되는 등 연구개발이 잘 진척되고 있다는 것이다.
셀그램-LC의 국내 임상 3상은 지난해 4월 첫 환자 등록을 시작해 원주세브란스기독병원 외 10개 기관에서 진행 중이다.
당초 파미셀은 2016년 6월 공개된 임상 2상 결과를 바탕으로 조건부 허가를 획득해 빠른 시판을 계획했었다. 파미셀은 2017년 식약처에 조건부 허가를 신청했으나 2019년 반려 결정을 받았다. 이후 조건부허가 반려처분 취소 행정소송을 진행하던 파미셀은 결국 조건부허가 획득 없이 셀그램-LC 국내 임상 3상을 개시했다.
그 다음으로 개발 단계가 앞서있는 파이프라인인 셀그램-ED의 임상 2상은 늦어도 내년 상반기에 종료될 것으로 예상된다. 셀그램-ED는 2020년 10월 국내 임상 2상 첫 환자 등록을 시작으로 서울아산병원 외 2개 기관에서 임상 2상을 진행 중이다.
일각에서는 파미셀의 파이프라인 재정비에 대해 적자를 내는 줄기세포치료제 사업 비중을 줄이기 위한 것 아니냐는 의혹도 내놨다. 최근 뉴클레오시드 생산 사업에 대해 과감한 투자를 이어가는 가운데 일부 임상을 정리하자 이 같은 추측이 제기된 것으로 보인다. 줄기세포치료제의 경우 상용화를 하더라도 수익성이 낮다는 점도 이 같은 의혹에 무게를 더했다.
실제로 파미셀은 급성심근경색증 치료제 ‘하티셀그램-AMI’로 세계 최초 줄기세포치료제 상용화에 성공한 업체다. 파미셀은 2011년 7월 식품의약품안전처로부터 하티셀그램-AMI 품목허가를 받고 시판에 돌입했다. 올해 상반기 하티셀그램-AMI의 매출액은 5억6900만원으로 전체 매출의 1.18%를 차지하고 있다.
이러한 의혹에 대해 파미셀 측은 “파미셀은 줄기세포치료제를 미래성장동력으로 삼고 있다”며 “줄기세포치료제 임상도 잘 진척되고 있다”고 일축했다. 이어 “뉴클레오시드 생산 등을 통해 발생시킨 수익을 바탕으로 줄기세포치료제 연구개발에 투자하고 있다”며 “외부 자금 조달 없이 자체적으로 R&D가 가능한 줄기세포치료제 업체는 드물다”고 강조했다.








![[포토] 송민혁 '우승과 함께 신인왕을 노린다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100474t.jpg)
![[포토] 화사, 매력적인 자신감](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100393t.jpg)
![[포토]이가영,부드러운 티샷 공략](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100330t.jpg)
![[포토] '트릭 오어 트릿' 진행하는 바이든 대통령 부부](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103102211t.jpg)
![[포토] 송민혁 '이글 2개, 버디7개 잡은 날'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100152t.jpg)
![[포토]치솟던 배춧값 대폭 하락…"물량 충분해"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101370t.jpg)
![[포토]삼성전자 반도체 영업익 4조](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101369t.jpg)
![[포토]하모니카 연주가 이윤석의 연주](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101230t.jpg)
![[포토]민통선 주민들 트랙터 시위](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101122t.jpg)
![[포토] 서울시예산안 설명하는 오세훈 시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100890t.jpg)