|
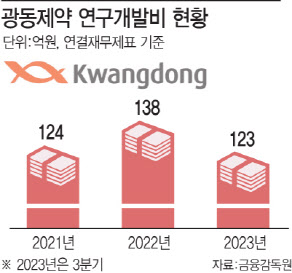
9일 제약업계에 따르면 광동제약의 지난해 3분기 연구개발 비용은 123억원을 기록했다. 이는 전년 동기(99억원)와 비교해 24.2% 증가한 수치다. 광동제약의 지난 2022년 연구개발비는 138억원으로 전년 124억원 대비 8.7% 증가했다. 이를 통해 신약 연구 개발에 대한 광동제약의 투자 개선 의지를 엿볼 수 있다.
광동제약의 지난해 3분기 매출 비중을 살펴보면 식품·음료(F&B영업)가 절반 이상인 55.8%(3869억원)를 차지하고 있다. 삼다수(2388억원) 관련 매출이 가장 많았고 뒤를 이어 비타500(796억원), 옥수수수염차(354억원), 헛개차(331억원) 등의 순이었다.
광동제약은 식품·음료에 치우진 사업 구조 탓에 매출(2022년 기준)은 국내 제약사 4위 수준인 1조4315억원에 달하지만 영업이익은 382억원에 그치고 있다. 이를 극복하기 위한 방법 중 하나로 식품·음료사업보다 상대적으로 수익성이 높은 전문의약품 사업 부분을 강화하는 것이다.
KD-101은 연필향나무 유래 세스퀴테르펜 화합물을 이용하는 점이 특징이다. 기존 비만치료제들은 지방흡수 또는 식욕을 억제하는 등의 방법을 통해 비만을 치료한다. KD-101은 이와 다른 독창적인 기전을 보유했다.
국내 비만치료제 시장은 가파르게 성장하고 있다. 국민건강보험공단에 따르면 최근 5년간 비만으로 진료받은 국민은 총 10만4000명, 진료비는 705억원가량에 이른다. 지난해 상반기 국내 비만치료제 시장 규모는 820억원으로 역대 최대치를 기록했다. 이는 전년대비 16.0% 증가한 수치다.
대신증권에 따르면 2030년 글로벌 비만 치료제 시장 규모는 1000억달러(약 131조원)에 이를 전망이다. 제약업계는 KD-101이 기존 치료제와 다른 독창적인 기전을 보유한 만큼 상용화될 경우 충분한 경쟁력이 있다고 보고 있다.
국내 아직 없는 소아근시 치료제 도입
소아근시 치료제는 아직 국내에 없는 상황으로 국내에서 상용화될 경우 소아 환자 치료에 많은 도움이 될 전망이다. 보건의료빅데이터개방시스템에 따르면 2021년 기준 국내 0~19세 소아·청소년 근시 환자는 전체 근시 환자의 55.3%를 차지한다. 광동제약은 NVK002의 아시아 권역 판권을 가지고 있는 자오커와의 계약을 통해 한국 내 수입·유통 등에 대한 독점 판매권을 보유했다.
광동제약은 이탈리아 희귀의약품 전문기업 키에시로부터 희귀질환 치료제 3종도 도입했다. 제품은 △젊은 성인기에 특징적인 시신경의 손상으로 인해 통증을 동반하지 않으면서 양쪽 시력이 진행성으로 악화되는 사립체성 유전 질환인 레베르시신경병증 치료제 락손 △소좀이라는 세포 내 소기관에서 특정한 당지질 대사에 필요한 효소가 결핍돼 발생하는 리소좀 저장 질환인 파브리병 치료제 엘파브리오 △유전성 리소좀축적병의 한 종류로서 특정 효소의 결핍으로 인해 만노사이드가 결합조직에 축적되는 질환인 알파·만노시드 축적증 승인 치료제 람제데 등 총 3종이다. 특히 람제데는 2022년 국가임상시험지원재단이 국내도입이 시급한 글로벌 신약 5위로 선정됐다.
광동제약 관계자는 “신약 개발과 치료제 도입, 그리고 자회사 KD인베스트먼트를 통한 오픈이노베이션 등 크게 세 축으로로 연구개발을 진행하고 있다”며 “식품·음료사업은 워낙 강점을 보이고 있는 만큼 이를 기반으로 전문의약품 등 조금씩 할 수 있는 사업 영역의 경쟁력을 강화하고 있다”고 말했다.






![[포토]여·야·의·정 협의체 1차 회의, '모두발언하는 한동훈'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100253t.jpg)
![[포토]이동은,우승 향한 브이](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111100040t.jpg)
![[포토] 소방 "포스코 포항제철소서 큰 불 신고"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000360t.jpg)
![[포토] 이대한 '2024시즌 대미를 장식하며 동료들과 함께'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000314t.jpg)
![[포토]의협 대의원총회 참석하는 임현택 회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000295t.jpg)
![[포토]잠시 쉬어가는 서울야외도서관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000281t.jpg)
![[포토]‘코리아세일페스타’ 개막…숙박·놀이공원·학습지 등 신규 참여](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000259t.jpg)
![[포토]정부, ‘비위 혐의 다수 발견’ 이기흥 체육회장 등 경찰 수사 의뢰](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000227t.jpg)
![[포토]수능대박을 위해](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000202t.jpg)
![[포토]가을의 추억](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24111000165t.jpg)

![[포토]최민경,정확한 티샷](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111100105h.jpg)