현재 상용화된 T 세포치료제의 적응증 확대를 위한 임상 중간 결과 발표도 예정돼 있어 매출 상승에 힘을 더할 전망이다.
|
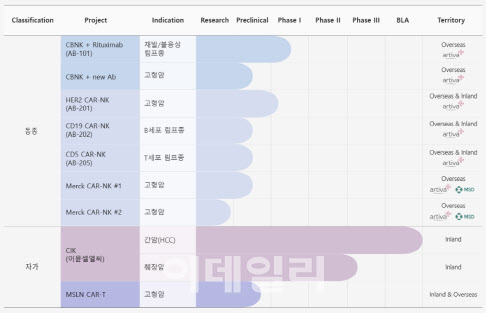
AB-201은 지씨셀의 전신인 GC녹십자랩셀이 2020년 아티바에 기술수출한 파이프라인 중 하나로, HER2 과발현 유방암 또는 위암 등의 고형암을 표적으로 한다. 지씨셀은 AB-201 개발 단계에 따라 마일스톤을 확보한다.
또 아티바는 이듬해인 2021년 미국 MSD와 새로운 CAR-NK 세포치료 후보물질 2종과 추가 옵션 1종 등 총 3종에 대한 공동 연구개발 계약을 체결했다. 이 가운데 지씨셀이 일부 업무를 담당하게 됐고 MSD-아티바, 아티바-지씨셀로 이어지는 계약이 이뤄졌다.
해당 계약 규모는 총 18억6600만달러(약 2조900억원)며 이 중 지씨셀로 직접 유입되는 금액은 총 9억8175만달러(약 1조980억원)다. 지씨셀은 이 중 반환 의무가 없는 계약금 1500만달러(약 170억원)를 수령했으며, 이후 물질마다 3억2225만달러(약 4300억원)의 마일스톤 금액(단계별 기술료)을 받는다.
지씨셀이 체결한 두 건의 기술수출의 마일스톤 계약 세부 내용은 공개되지 않았지만, 업계에서는 올해 안으로 AB-201 임상 첫 환자 등록 및 투여가 시작되고 아비타와 MSD의 추가 항체 선정이 이뤄지는 경우 업계는 지씨셀이 최대 200억원 안팎의 기술료를 획득 할 것으로 추정하고 있다.
특히, AB-201의 경우 현재 가장 널리 쓰이는 항체치료제 ‘허셉틴’ 보다 동물모델에서 높은 생존률을 보이면서 전세계의 이목을 집중시켰던 만큼 아티바와의 계약 이외 지역인 아시아 및 오세아니아에서 추가 기술수출 가능성도 있다. 아울러 올해 FDA로부터 희귀의약품으로 지정받은 만큼 이후에도 개발에 속도가 붙을 전망이다.
이번 임상이 실시되는 최대용량군의 경우 치료제의 세포 수를 기존 10억셀에서 40억셀로 늘린 만큼 더 확실한 치료 효과가 기대된다.
이뮨셀LC, 적응증 추가로 매출 상승 기대
이밖에 2007년 간암 면역세포치료제로 품목허가 받은 이뮨셀LC의 경우 적응증 추가를 통해 매출 확보에 힘을 더할 전망이다.
지씨셀은 2021년 408명의 췌장암 환자를 대상으로 이뮨셀LC의 효능을 확인하기 위한 임상 3상을 허가받아 실시 중이며, 빠르면 내년 1분기 중간분석 데이터 발표가 기대된다.
특히, 이뮨셀LC는 이미 췌장암과 유방암 환자들에게 ‘오프라벨’(off label) 처방이 이뤄지고 있기 때문에 수요도 충분하다는 분석이다. 오프라벨 처방은 의료진들의 판단에 따라 이뤄지는 것인 만큼 의료진들의 기대감이 높다는 의미이기도 하다. 의료계 등에 따르면 현재 이뮨셀LC는 매 분기 70억원 가량의 매출을 발생시키고 있는데, 췌장암 적응증까지 획득하면 매 분기 100억원의 매출도 가능할 것으로 업계는 예상하고 있다.
지씨셀 관계자는 “올해 하반기부터 내년 상반기까지 여러 가지 성장 모멘텀이 있다”라며 “이뮨셀LC는 인도 외 다른 글로벌 무대를 향한 기술수출도 기대된다”고 말했다.







![[포토] 광화문광장 나눔온도 70.5도](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600729t.jpg)
![[포토]조중석 이스타항공 대표-고토다 도쿠시마현지사 인사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600693t.jpg)
![[포토]여야 합의 강조하는 한덕수](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600665t.jpg)
![[포토]김용현 전 국방부 장관 변호인단 기자회견 열어](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600563t.jpg)
![[포토]윤이나,밝은 모습 인터뷰 시간](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600087t.jpg)
![[포토]명동성당 성탄 대축일 미사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500276t.jpg)
![[포토]다시 돌아온 있지 리아](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500136t.jpg)
![[포토]크리스마스엔 스케이트](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500245t.jpg)
![[포토]37번째 거리 성탄예배 열려 방한복·도시락으로 사랑 나눔](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500231t.jpg)
![[포토]조국혁신당 공수처 앞에서 기자회견](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500219t.jpg)
![[포토]윤이나,후배 양성을 위해 2억원 기부했어요](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122600088h.jpg)



