|
백토서팁은 TGF-β(티지에프-베타) 신호 전달 억제제로 약물을 원활하게 전달해 암의 성장을 억제하는 기전을 갖고 있다. TGF-β는 암세포가 면역세포의 공격을 막기 위해 보호벽인 섬유질을 쌓기 위해 분비하는 물질이다. 백토서팁이 기존 항암제와 병용 임상을 많이 진행하는 것은 다양한 암치료제가 암세포를 공격할 수 있게 돕는 작용기전을 갖고 있기 때문이다.
면역항암제와 병용 임상은 글로벌 연구개발 트렌드와도 부합하는 방식이라는 게 회사 측의 설명이다. 메드팩토 관계자는 “명확한 타깃을 발굴해 단독요법을 중심으로 진행했던 초기 명역항암제 개발 열기를 지나 병용요법의 개발이라는 항암 치료의 제2라운드에 돌입했다”고 짚었다. 2019년 9월 기준으로 면역관문억제제 병용임상은 2975건에 이른다.
지난해 임상 전략 변경…우선순위로 대장암·췌장암·골육종 ‘낙점’
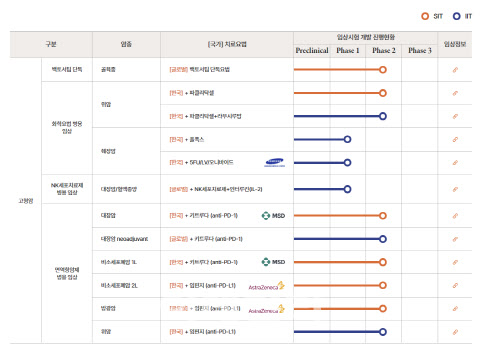
백토서팁은 2013년 미국 임상 1상을 개시해 안전성과 내약성을 확보했다. 2016년부터는 미국 임상 2상을 승인받아 다양한 병용 임상을 진행해왔다. 2019년 12월 코스닥 상장 당시 진행 중이었던 6건이었던 병용 임상은 한때 13건까지 늘었다. 그러나 메드팩토는 지난해 시장성이 낮은 적응증인 데스모이드 국내 임상 2상을 자진 철회하면서 임상 파이프라인 다이어트에 들어섰다.
앞서 메드팩토는 지난해 3월 티모시 R. 알렌(Timothy R. Allen) 박사를 미국 자회사 메드팩토 테라퓨틱스(MedPacto Therapeutics, Inc.) 임상총괄 부사장으로 영입하면서 파이프라인 재평가에 들어갔다. 알렌 메드팩토 테라퓨틱스 부사장은 백토서팁으로 진행 중인 13개 임상에 대해 재평가한 후 대장암, 췌장암, 골육종 등 3개 적응증에 대한 임상을 우선순위로 선정했다.
메드팩토 측은 “2018년부터 2021년까지가 모든 암종으로 확장 가능성, 모든 항암제와 병용 투여 가능성을 증명하기 위한 확장 단계의 임상이었다면 지난해부터는 상업화 단계 임상으로 백토서팁 개발 전략을 바꿨다”고 설명했다.
|
췌장암의 경우 ‘오니바이드’ 병용 임상 2상 진입을 위해 미국과 한국에서 환자 모집 중이다. 골육종 단독 임상 1상의 경우 한국에서는 환자 모집을 시작했으며, 미국에서는 조만간 환자 투약이 시작될 전망이다. 대장암의 경우 올해 상반기 내 키트루다 병용 임상 3상 IND를 신청하기 위해 전사 역량을 투입하고 있다.
대장암 3상 IND 신청 주력하는 이유는?
메드팩토가 우선순위 임상 중에서도 대장암에 주력하고 잇는 이유는 가장 빠른 상용화가 기대되는 적응증이기 때문이다. 메드팩토는 빠른 시일 내에 성과를 낼 수 있는 임상에 집중해 FDA로부터 시판 허가를 획득한 뒤 적응증을 늘리는 추가 임상을 진행하는 편이 상용화를 앞당길 것이라고 보고 있다.
대장암이 시장성이 높은 적응증이라는 점도 우선순위임상으로 선정되는 데 한몫 했다. 블루위브 컨설팅&리서치(Blueweave Consulting & Research Private Limited)에 따르면 글로벌 대장암 치료 시장 규모는 2021년 123억8000만달러(약 16조원)에서 2028년 201억6000만달러(약 26조원)에 이를 것으로 추정된다.
|
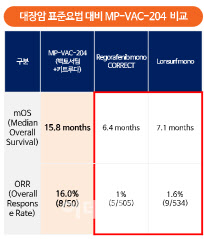
메드팩토가 발표한 백토서팁과 키트루다 병용 임상 2상 결과 전체 생존기간 중앙값(mOS)은 15.8개월, 객관적 반응률(ORR)은 16%(50명 중 8명)로 나타났다. 이는 대장암 표준치료법인 ‘레고라페닙(regorafenib, 스티바가) 단독요법의 mOS 6.4개월, ORR 1%(505명 중 5명)보다 개선된 수치다. ‘론서프(Lonsurf)’단독요법도 mOS 7.1개월, ORR 1.6%(534명 중 9명) 수준이었다.
최근에는 머크와 일본 에자이가 흑색종과 대장암을 대상으로 진행한 키트루다와 렌비마 병용 임상 3상을 중단하면서 경쟁약이 물러서게 됐다. 이에 따라 메드팩토의 백토서팁과 키트루다의 글로벌 임상 3상에 기대감이 쌓이고 있다.
한편 메드팩토는 임상 파이프라인에 대해 선택과 집중 전략을 취하고 있지만 동시다발적으로 임상을 진행할 만한 자금력도 뒷받침되고 있는 상황이다. 메드팩토의 지난해 말 단기금융상품을 포함한 현금성자산은 970억원을 보유하고 있다. 메드팩토는 최근 3년간 연구개발비로 2020년 240억원→2021년 246억원→2022년 319억원을 사용해왔다. 약 300억원씩 매년 사용한다고 가정해도 3년은 무리없이 집행 가능한 수준이다.








![[포토]한덕수 대통령 권한대행 국무총리 탄핵소추안 투표하는 우원식 국회의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700978t.jpg)
![[포토] 달러 상승 이어져...](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700871t.jpg)
![[포토] 헌법재판소 소심판정](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700760t.jpg)
![[포토] 정청래 단장과 김이수 전 헌법재판관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700742t.jpg)
![[포토] 윤석열 법률대리인 헌재 출석](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700731t.jpg)
![[포토]내수경기활성화 민당정협의회 열려](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700609t.jpg)
![[포토]입장하는 이재명 대표](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700546t.jpg)
![[포토] 달려라~](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700515t.jpg)
![[포토]이재명 "한덕수·국민의힘 내란 비호세력 탄핵 방해로 민생 경제 추락"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122700363t.jpg)
![[포토]윤이나,후배 양성을 위해 2억원 기부했어요](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122600088h.jpg)
![45년간 자리 지킨 ‘포프모빌’…전기차로 바뀌었다는데[누구차]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122800166h.jpg)


![한강뷰 보며 케이터링 즐긴다…호텔 같은 ‘이 회사’[복지좋소]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122800051h.jpg)