“안전하게 진행되길 원하는 것”
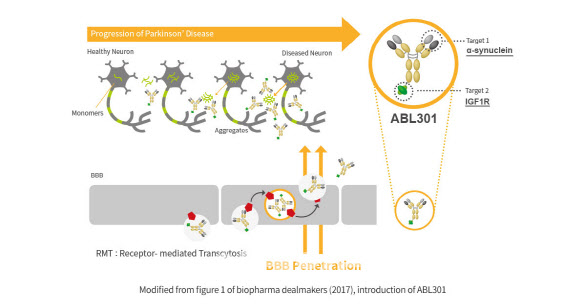
13일 제약·바이오 업계에 따르면 에이비엘바이오는 전날 공시를 통해 “미국 FDA로부터 ABL301 1상 IND 심사결과 ‘부분 임상 보류(Partial Clinical Hold)’를 받았다고 밝혔다. FDA는 에이비엘바이오의 비임상 데이터는 ABL301을 사람에게 최대 20mg/kg까지만 투여할 수 있다는 것을 의미하며 이 용량을 초과하는 부분에 대해서는 임상시험을 할 수 없다는 것이다. 에이비엘바이오는 단일용량증량시험에서 최대 80mg/kg의 용량을 계획한 바 있다.
|
지난해 말 지명된 로버트 칼리프 미국 FDA가 과거보다 엄격한 잣대를 세우고 있다는 분석도 나왔다. 마약성 진통제 오피오이드 승인 책임자로 비판을 받은 바 있어서다. 허혜민 키움증권 연구원은 “뇌혈관장벽(BBB) 셔틀 플랫폼 기반의 첫 임상 진입이고 IGF1R 타겟으로도 처음이기 때문에 규제당국이 안전하게 진행되길 원하는 것으로 추측한다”고 말했다.
“임상 일정·비용 문제 없다”
일정은 미뤄지지 않는다는게 회사측 설명이다. 에이비엘바이오 관계자는 “저용량을 임상 하는 중에 고용량 임상을 위한 프로세스를 거칠 것”이라며 “저용량 임상이 끝날 즈음에 고용량 임상을 자연스럽게 시작할 수 있을 것”이라고 말했다. 고용량을 임상을 위해 따로 영장류 독성실험(GLP)을 진행해서 추가 데이터를 FDA에 제출해 고용량도 진행한다는 계획이다.
GLP 실험에 대한 추가 비용이 드는 것이 현재로서는 아쉬운 점이다. 에이비엘바이오 관계자는 “임상을 진행할만한 여유자금이 풍부해서 비용적인 문제는 걱정하지 않고 있다”고 설명했다. 올해 3분기 기준 에이비엘바이오가 보유한 예금 등 보유자금 합계는 연결기준 1633억원이다.








![[포토] 송민혁 '우승과 함께 신인왕을 노린다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100474t.jpg)
![[포토] 화사, 매력적인 자신감](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100393t.jpg)
![[포토]이가영,부드러운 티샷 공략](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100330t.jpg)
![[포토] '트릭 오어 트릿' 진행하는 바이든 대통령 부부](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103102211t.jpg)
![[포토] 송민혁 '이글 2개, 버디7개 잡은 날'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100152t.jpg)
![[포토]치솟던 배춧값 대폭 하락…"물량 충분해"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101370t.jpg)
![[포토]삼성전자 반도체 영업익 4조](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101369t.jpg)
![[포토]하모니카 연주가 이윤석의 연주](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101230t.jpg)
![[포토]민통선 주민들 트랙터 시위](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101122t.jpg)
![[포토] 서울시예산안 설명하는 오세훈 시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100890t.jpg)


!["10억 벌었다? 자칫 다 날릴 수도"…'잠실 로또' 당첨 주의점은?[떳다리]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110101085b.jpg)
