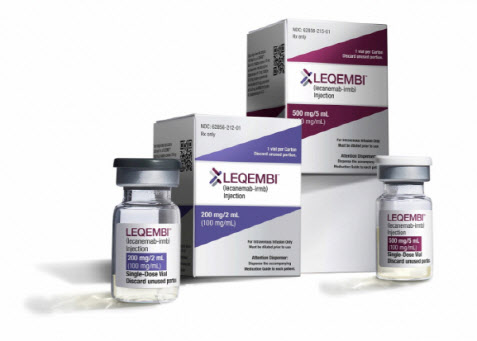
레켐비는 지난 7월 FDA 허가를 획득한 경도 인지장애 및 초기 알츠하이머 치료제다. 기존 정맥주사 IV 제형으로 개발돼 환자가 2주에 한번 병원을 방문해 투여받아야 한다. 회사 측이 미국식품의약국(FDA)의 SC 제제 허가를 획득할 경우 환자들이 병원을 방문하지 않고도 자가주사가 가능해져, 편의성과 치료 순응도 향상에 기여할 것으로 기대된다. 에자이는 앞서 지난 3월 말 ‘레켐비’ 월 1회 정맥주사 유지요법제의 허가신청서를 FDA에 제출한 바 있다.
최근 일본 외신에 따르면 에자이 및 바이오젠은‘레켐비’(레카네맙-irmb) 피하 자가주사제 주 1회 유지요법의 허가를 FDA에 신청하기 위한 순차제출(rolling submission) 절차를 개시했다고 공표했다.
|
FDA의 허가를 취득할 경우 ‘레켐비’ 자가주사제는 자택 또는 의료기관에서 이 알츠하이머 치료제를 투여할 때 활발하게 사용될 수 있을 것으로 보인다. 특히 피하 주가주사제는 약물을 투여하는 데 필요로 하는 시간이 정맥주사제에 비해 훨씬 적게 소요될 것이라는 장점이 눈에 띈다.
360mg 주 1회 피하 자가주사 유지요법제 심사과정의 일환으로 정맥주사제 격주 1회 투여 착수단계를 마친 환자들은 고도의 독성을 나타내는 원시섬유(protofibrils 용해성 응집인자)를 지속적으로 제거하기 위해 유효농도의 ‘레켐비’를 주 1회 투여받아야 한다. 원시섬유는 뇌내에서 아밀로이드-베타 플라크를 제거한 후에도 지속적인 신경손상을 유발할 수 있는 것으로 알려져 있다.
현재 ‘레켐비’는 미국, 중국 및 일본에서 허가를 취득해 사용되고 있는 가운데 한국, EU, 호주, 브라질, 캐나다, 홍콩, 영국, 인도, 이스라엘, 러시아, 사우디 아라비아, 타이완, 싱가포르 및 스위스 등에서 허가신청서가 제출된 단계다.









![[포토]마다솜,버디로 올라간다](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110800552t.jpg)
![[포토] 가축분 고체연료 협약 인사말하는 김준동 남부발전 사장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110801640t.jpg)
![[포토] 장유빈 '정교함까지 장착한 장타자'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110800230t.jpg)
![[포토]예결위 전체회의, '답변하는 한덕수 국무총리'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110801228t.jpg)
![[포토]난방용품 바라보는 소비자](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110701539t.jpg)
![[포토]트럼프 대툥령 당선에 환율 1400대 돌입 임박](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110701513t.jpg)
![[포토] 장동규 '강한 임팩트를 구사'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110700185t.jpg)

![[포토]윤석열 대통령 대국민 담화](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110701048t.jpg)
![[포토]예산결산특별위원회 전체회의](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110700871t.jpg)

![[포토]박현경,선두 향한 미소](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24110900017h.jpg)


