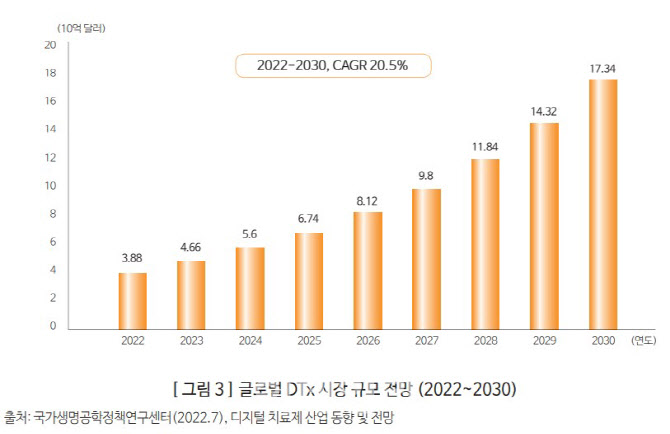
한국보건산업진흥원 ‘주요국 DTx 관련 정책 및 산업 동향’ 리포트에 따르면 글로벌 DTx 시장은 2022년 38억8000만 달러 규모로 추정되며, 연평균 20.5% 성장해 2030년 173억4000만 달러에 달할 것으로 전망된다. 시장이 급속도로 확대되면서 경쟁도 치열해 질 것으로 보인다.
|
2010년 미국 식품의약국(FDA)가 승인한 2형 당뇨병 환자 치료를 위한 자기 관리앱 웰독사의 블루스타(BlueStar)를 시작으로 2020년까지 당뇨병, 심부전, 천식, 만성 폐색성 폐질환, 오피오이드 사용장애, 만성 불면증, ADHD(주의 부족·다동증), PTSD(심적 외상 후 스트레스 장애) 질병에 대한 DTx 제품화로 이어졌다. 2022년 3월 말 기준 DTx 개발기업과 제품은 각각 16개, 20개로 집계된다. 16대 기업 중 75%가 비상장기업이고, 2010년 이후 창업한 기업은 75%다.
특히 디지털 치료제 업계는 보험 급여 필요성을 주장하고 있는데, 미국의 경우 공공의료보장 제도인 메디케어에 의한 공식적인 정책은 존재하지 않고 있다. 단 민간보험 및 고용주가 제공하는 복리후생 프로그램에서는 일부 프로그램 의료기기를 포함하는 경우가 있다. 또한 메디케어 운영 주체인 보건복지부 산한 보건의료재정청(CMS)는 2021년 첨단 의료를 이용한 의료기기를 일부 메디케어에 포함해야 한다고 주장했다.
2022년 2월 CMS는 ‘처방 디지털 행동요법(PDT)’에 새로운 수준Ⅱ의 의료 공통 치료행위 코딩 시스템을 적용하기로 발표했다. 이는 DTx 기업이 개발하는 소프트웨어 기반 치료기기가 메디케이드와 민간 보험의 급여 대상이 쉽게 될 수 있는 계기가 됐다. 3가지 종류의 DTx 제품에 대해 FDA 승인을 받고 있는 Pear Therapeutics사는 처방 PDT에 코드 번호를 부요하는 것을 CMS에 요청했고, 코드가 부여되면 향후 DTx 보급이 확대될 전망이다.
임시등재와 영구등재로 구분되는데, 임시등재의 경우 보험 급여를 받기 위해 첫해 동안 DiGA 제조사는 해당되는 경우, 공공의무보험(SHI)과 민간보험(PHI), 급여를 자체적으로 설정할 수 있다. 영구등재는 환급 가격은 향후 모든 연도에 대해 공적 의료보험 조합과 협상 및 합의 과정을 거쳐 설정된다.
한국도 국제적 흐름에 맞춰 DTx 분야에 대해 R&D 지원, 제도 개선 및 관련 입법을 꾸준히 추진 중이다. DTx 관련 정부 R&D 투자는 최근 5년(2015~2019년) 동안 총 442억원이고, 연평균 25.3%로 급격히 증가하고 있다. 또한 DTx 제품화 및 상용화를 위해 디지털 진단치료기기 인허가 가이드라인을 마련해 국가 기준을 제시하고 있다.







![[포토]김용현 전 국방부 장관 변호인단 기자회견 열어](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600563t.jpg)
![[포토]윤이나,밝은 모습 인터뷰 시간](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122600087t.jpg)
![[포토]명동성당 성탄 대축일 미사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500276t.jpg)
![[포토]다시 돌아온 있지 리아](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500136t.jpg)
![[포토]크리스마스엔 스케이트](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500245t.jpg)
![[포토]37번째 거리 성탄예배 열려 방한복·도시락으로 사랑 나눔](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500231t.jpg)
![[포토]조국혁신당 공수처 앞에서 기자회견](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500219t.jpg)
![[포토]우리 이웃을 위한 크리스마스 선물](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122500173t.jpg)
![[포토]메리크리스마스](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400797t.jpg)
![[포토]즐거운 눈썰매](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24122400779t.jpg)

![[포토]윤이나,후배 양성을 위해 2억원 기부했어요](https://spnimage.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24122600088h.jpg)


