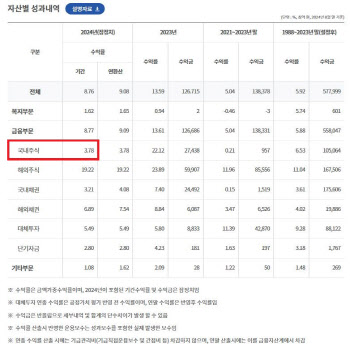
|
마지막 투여를 완료해 임상시험이 종료됨에 따라 회사는 3년여 이어진 임상 3상 참여환자 126명에 대한 임상 결과 분석을 시작할 수 있게 됐다.
공식적인 임상시험 최종 결과 발표는 내년 1분기로 예상하지만 그에 앞서 주요 데이터는 빠르면 연내 받아 볼 수 있다는 것이 회사의 입장이다. 회사 관계자는 “이번 임상은 약물 허가를 위한 최종적인 임상 시험일 뿐 아니라 한·미 양국의 규제기관 모두를 만족시켜야 하는 만큼 데이터 분석에 어느 때보다 신중을 기할 것”이라고 했다.
뉴로나타 알의 임상 3상은 지난 2020년 식품의약품안전처와 미국 식품의약국(FDA)으로부터 동시 승인 받아 국내 총 5곳의 대학 병원에서 진행돼왔다. 지난 2021년 본격적인 임상시험을 개시했으나 코로나19 팬데믹 영향으로 환자 모집에 난항을 겪으면서 종료 목표 시점은 지난해에서 올해로 연기됐다.
양길안 코아스템켐온 대표이사는 “코로나19로 임상시험 진행이 지체되는 등 어려움이 있었지만 전화위복 삼아 뉴로나타 알의 성공을 위한 안정적인 환경을 조성하는 데 집중했다”며 “세계 최초 루게릭병 줄기세포 치료제 성공가능성에 대한 기대가 크다”고 말했다.
코아스템켐온 관계자는 “임상 3상이 종료되면 관련 소식을 글로벌 제약사들에게 곧바로 알릴 계획”이라며 “임상 데이터가 일정 수준 확보된다면 신약 신청 이전까지 활발하게 논의가 이루어질 것으로 예상한다”고 말했다.
뉴로나타 알은 코아스템켐온의 자체개발 신약으로 지난 2014년 식약처로부터 조건부 허가를 받았다. 현재까지 420명이 넘는 국내·외 환자가 루게릭병 치료를 위해 줄기세포 치료제 뉴로나타 알을 투여받았다. 미국에서 판매 중인 경쟁 치료제인 미쓰비시타나베사의 ‘라디컷’은 지난해 약 7500억원의 글로벌 매출을 올렸기 때문에 업계에서는 뉴로나타 알이 임상 3상에 성공할 경우 최소 7000억원 이상의 매출을 예상하고 있다.









![[포토] 송민혁 '우승과 함께 신인왕을 노린다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100474t.jpg)
![[포토] 화사, 매력적인 자신감](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100393t.jpg)
![[포토]이가영,부드러운 티샷 공략](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100330t.jpg)
![[포토] '트릭 오어 트릿' 진행하는 바이든 대통령 부부](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103102211t.jpg)
![[포토] 송민혁 '이글 2개, 버디7개 잡은 날'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100152t.jpg)
![[포토]치솟던 배춧값 대폭 하락…"물량 충분해"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101370t.jpg)
![[포토]삼성전자 반도체 영업익 4조](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101369t.jpg)
![[포토]하모니카 연주가 이윤석의 연주](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101230t.jpg)
![[포토]민통선 주민들 트랙터 시위](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101122t.jpg)
![[포토] 서울시예산안 설명하는 오세훈 시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100890t.jpg)